Los ciclos reproductivos están regulados por factores ambientales, genéticos, fisiológicos, de comportamiento, psicosociales y endocrinos, siendo la interacción de las hormonas sexuales la responsable del desarrollo y evolución del funcionamiento reproductivo del individuo en cada una de ellas.
La secreción de hormonas comienza siempre durante la vida fetal, poco después de la diferenciación sexual, reduciendose al final de la misma unos dos meses antes del nacimiento. Los niveles se mantienen bajos hasta el inicio de la pubertad, período durante el cual se eleva paulatinamente, tanto en animales enteros como en castrados en edad temprana, caso en el cual el proceso es más claro debido a la ausencia de la retroalimentación negativa de los esteroides.
La estructura de los ovarios presenta los cambios necesarios para la diferenciación sexual, hasta que al final de la gestación el ovario contiene millones de folículos primarios dentro de una estructura de tejido intersticial organizado en el epitelio ovárico denominado anteriormente epitelio germinal.
La estructura básica de los testículos, conductos seminíferos y tejido intersticial, permanece sin cambios desde la diferenciación sexual de las gónadas al comienzo del período fetal hasta la pubertad.
El grado de fertilidad se inicia durante la pubertad y se mantiene durante varios años declinando con la edad. No se logra la eficiencia total de reproducción en ninguna de las especies durante la primera aparición del estro o durante la primera eyaculación. Existe un período de esterilidad adolescente, el cual es notablemente corto, unas cuantas semanas, en los animales domésticos.
La secreción de gonadotropinas como de factores de crecimiento comienzan en la vaca durante la vida fetal, un poco después de la diferenciación sexual, primero o segundo mes de gestación. Esta secreción involuciona temporalmente y en el bovino disminuye un poco dos meses antes del nacimiento, para elevarse posteriormente al inicio de la pubertad.
La disminución en la secreción de gonadotropinas está relacionada con la maduración del SNC y ocurre cuando las estructuras superiores del cerebro se hacen cargo de la actividad hipotalámica. El aumento en la liberación de gonadotropinas causa la eliminación del control inhibitorio del SNC, al tiempo que el desarrollo corporal alcanza poco a poco un tamaño compatible con la reproducción.
Durante la vida fetal y neonatal, la gametogénesis y esteroidogénesis son independientes, en tanto que en la pubertad se relacionan en forma estrecha. Hay evidencias que permiten afirmar que las gonadotropinas no están involucradas en el inicio de la foliculogénesis, la cual estaría controlada por “Factores de Crecimiento” intraovaricos, los cuales de alguna manera determinarían tanto el número como el momento en que estos folículos comienzan a crecer. Cuando un folículo abandona la población de folículos de reserva continúa su crecimiento hasta que es ovulado, o bien se atresia. Por lo tanto no existe una población de folículos de reserva con antro. (ARRAU)
PUBERTAD Y MADUREZ SEXUAL
La funcionalidad del hipotálamo en el macho y la hembra es diferente y esta diferencia se establece desde el desarrollo prenatal, manteniéndose durante la vida reproductiva de ambos sexos.
El hipotálamo es inherentemente femenino. Durante la embriogénesis la testosterona fetal “desfeminiza” el cerebro lo cual consiste en la minimización de la funcionalidad del centro de oleada del hipotálamo y por consiguiente la secreción y liberación solo de niveles tónicos de GnRH en forma ritmo pulsátil, originando un mismo comportamiento de las ondas de liberación de LH las cuales se presentan en el macho cada 2 a 6 horas después de la pubertad.
Por el contrario en la hembra el centro de oleada permanece y la secreción y liberación de GnRH se traduce en secreción y liberación de oleada de LH y estradiol cada 20 días, además de las ondas tónicas de cada una de ellas.
Para que suceda la desfeminización del hipotálamo en el macho, es necesario que la testosterona se convierta en estradiol lo cual es posible al pasar la testosterona la barrera sanguínea del cerebro.
En la hembra la cual produce estradiol fetal no se presenta este proceso debido a que este se une a una proteína llamada alfa-FetoProteina –αFP- que impide el paso del estradiol por la barrera sanguínea del cerebro. Por tal razón el estradiol no afecta el hipotálamo.
En la práctica un animal macho o hembra alcanza la pubertad cuando es capaz de liberar gametos y manifestar signos de comportamiento sexual. Es el resultado de los ajustes graduales entre el incremento de la actividad gonadotrópica y la capacidad de las gónadas para iniciar simultáneamente la gametogénesis y la esteroidogénesis.
Se considera que antes de la pubertad hay un período prepuberal o de infancia. Su duración es extremadamente variable, siendo dependiente de factores como la raza, la alimentación y los sistemas de cría. En la vaca dura aproximadamente 3 meses.
En la pubertad se establecen las relaciones funcionales entre el hipotálamo, adenohipófisis y gónadas. La liberación de gonadotropinas antes de la pubertad es más o menos continua, pero en esta etapa la concentración crece debido a una elevación tanto de la amplitud como de la frecuencia de impulsos periódicos, especialmente en la hembra.
PUBERTAD EN EL MACHO
En el macho, en respuesta a la liberación de gonadotropinas, se elevan los niveles de testosterona desde cifras muy bajas hasta concentraciones de adulto. Inicialmente cada impulso de LH es seguido de un aumento transitorio de testosterona cada hora, luego el grado de secreción de testosterona aumenta a medida que avanza la pubertad para finalmente quedar elevado definitivamente. El incremento de testosterona en sangre hace que disminuya la secreción de gonadotropinas mediante un proceso de retroalimentación negativa.
La pubertad en el macho se define como la edad en que el eyaculado contiene suficientes espermatozoides para inducir la gestación en una hembra. En el bovino ocurre cuando el eyaculado contiene 50 millones de espermatozoides con por lo menos un 10% de motilidad progresiva (ALMQUIST)
Los machos intentarán montar las hembras pocos meses después del nacimiento, sin embargo el pene del becerro se encuentra firmemente adherido dentro de la vaina por el frenillo prepucial y no puede extenderse, para a los dos a cuatro meses, antes de la pubertad, se presenta una protrución parcial del pene durante las montas, seguido de una separación del pene de la vaina y una erección completa, logrando al final de la pubertad consumar el apareamiento y la eyaculación de espermatozoides.
Uno de los cambios iniciales de la pubertad en el torete es el incremento de la frecuencia de liberación pulsátil de LH entre las 12 y 20 semanas, las cuales estimulan a las células de Leydig para que secreten testosterona, la cual es necesaria para la diferenciación de las células de Sertoli y la espermatogenesis (AMMAN)
Existen diferencias raciales en la edad y el peso corporal a la pubertad. Los toros Holstein alcanzan la pubertad antes que los Angus y los Hereford. Los toretes de cruces con razas de carne generalmente llegan a la pubertad más temprano que los de raza pura. (HAFEZ)
PUBERTAD EN LA HEMBRA
A medida que la pubertad se acerca en la novilla, se establece un patrón de liberación cíclica de LH, con luteinización de algunos folículos, los cuales secretan bajos niveles de progesterona, la cual es necesaria para el establecimiento de la liberación de FSH durante este periodo puberal. En la hembra solo se segrega estradiol cuando se han desarrollado folículos con antro. Su teca interna, formada por tejido intersticial segrega principalmente testosterona a la que las células granulosas convierten en estradiol. Lo anterior conduce a un aumento en la capacidad de las hormonas liberadoras secretadas por el hipotálamo para regular las gonadotropinas y producir un aumento en la concentración de gonadotropinas hipofisiarias.
Durante la pubertad se presentan ovulaciones acompañadas de celos silenciosos, no presentando muchas de las hembras signos externos de celo, lo cual puede deberse a la falta o deficiente sensibilización por parte de la progesterona.
La edad promedio de la pubertad en novillas Bos taurus de leche es de 11 a 12 meses, con pesos que oscilan entre lo 240 y 260 Kls, siendo para novillas de carne de 11 y 14 meses, con pesos entre los 220 y 300 Kls. El ganado Bos indicus alcanza la pubertad entre los 6 a 12 meses. (SCHROEDER)
La calidad de la nutrición modula la edad de la pubertad. Si se acelera el crecimiento con sobrealimentación, el animal llega más pronto a la pubertad. La condición del peso corporal prima sobre la edad. La desnutrición retarda la aparición de la pubertad al disminuir la producción y liberación de las hormonas gonadotropas. Igualmente la presencia del macho estimula el inicio de la pubertad.
La madurez sexual se alcanza entre los 5 a 7 meses después de la pubertad, es decir entre los 13 a 24 meses de edad. Se recomienda hacer el primer servicio cuando la hembra alcanza los 350 Kls en ganado de leche y en el cebú a los 380 Kls según la Asociación Cebú.
CICLO ESTRAL
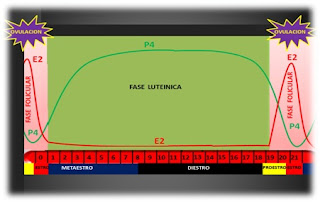
Se denomina ciclo estral a las diferentes etapas que se suceden entre dos períodos de estro o celo, los cuales se manifiestan en forma regular a espacios definidos o cíclicos durante todo el año y que coincide con la ovulación o liberación del óvulo por parte del ovario.
El ciclo estral tiene por objeto preparar las condiciones favorables para la fecundación, nidación y desarrollo del feto. Representa un proceso complejo de modificaciones morfológicas y endocrinas del tracto reproductivo y SNC.
Las estructuras palpables del ovario durante el ciclo estral son:
• Folículo en donde se desarrolla el óvulo y se secretan los estrógenos
• El Cuerpo Lúteo encargado de producir la progesterona cuya función es la de favorecer la implantación del embrión y mantener la gestación
Presenta dos etapas básicas y definidas dependiendo de las estructuras y el tipo de secreción ovárica predominante. Fase Estrogénica con presencia de Folículo y Fase Luteínica con presencia de Cuerpo Lúteo.
• Metaestro
o Es el período que sigue al estro.
o Durante este período disminuyen los síntomas de celo y la hembra no acepta el macho.
o Disminuye la influencia estrogénica.
o La cavidad folicular se llena de sangre para formar el Cuerpo lúteo.
o En novilla y algunas vacas se presenta a los 2 días una secreción mucosa sanguinolenta.
• Diestro
o Es el período de desarrollo y función del Cuerpo Lúteo.
o Tiene por ello influencia marcada de la progesterona.
o El útero está preparado para la implantación del embrión.
o Se inicia después del día 5 hasta el día 17.
o Si hay fecundación continúa el desarrollo del embrión y el feto y la gestación prosigue
hasta el parto
o Si no hay fecundación el Cuerpo lúteo se destruye por acción de la prostaglandina.
• Proestro
o Tiene una duración promedio de 3 días.
o Externamente se manifiesta por inquietud del animal, aunque aún no acepta ser montada.
o Internamente se presenta crecimiento del folículo y maduración del óvulo.
o Está influido
por los estrógenos.
• Estro
o Es el período durante el cual la hembra acepta ser montada y durante el cual se presenta la
ovulación.
o Existe una marcada influencia estrogénica
o Tiene por objeto preparar las condiciones necesarias para la fecundación, implantación del
embrión y desarrollo del feto
o Su duración promedia es de 18 horas en ganado de leche. En razas cebuinas dura
aproximadamente 5 – 7 horas.
o La duración del estro depende de la especie y varía ligeramente de una hembra a otra dentro
de la misma especie. La ovulación ocurre a las 18 horas después de iniciado el estro.
o La estimulación del grupo de hembras por el macho reduce la duración del estro y el
momento de la ovulación. Igualmente su duración varía por factores ambientales, de foto
período y estímulos externos.
o El celo es más corto en animales en pastoreo que en estabulación.
o El celo se manifiesta
- CELOS DE 6 AM A MEDIO DIA 22%
- CELOS DE MEDIO DIA A 6 PM 10%
- CELOS DE 6 PM A MEDIA NOCHE 25%
- CELOS DE MEDIA NOCHE A 6 AM 43 – 68%
o El ganado cebú lo manifiesta especialmente en las horas de la madrugada y al final de la
tarde.
o La ovulación tiene lugar al final del celo en promedio 15 a 18 horas después de iniciado.
En algunas especies se presenta un período de Anestro fisiológico o descanso sexual.
Hay diferencias entre especies en cuanto a la duración y manifestación de cada una de estas fases del ciclo estral.
CINETICA Y DINAMICA FOLICULAR
La naturaleza cíclica de la reproducción en el bovino se manifiesta mediante Ondas de Crecimiento Folicular u Ondas Foliculares, cuyo patrón se repite durante la pubertad, la preñez y el período postparto y fueron descubiertas con la aparición del ultrasonido.
El Desarrollo Folicular -DF- es un proceso continuo que finaliza con la ovulación y consta de dos fases:
La primera conocida como “Desarrollo Folicular Basal” la cual está bajo control paracrino de los Factores de Crecimiento –FC-. Durante esta fase la FSH puede ejercer un efecto mitogénico indirecto sobre las Células Germinales –CG- por aumento en la expresión de los FC o sus receptores.
La segunda se conoce como “Desarrollo Folicular Terminal” y depende estrictamente de las Gonadotropinas. El crecimiento es rápido debido a importantes cambios en la diferenciación de las células foliculares de la granulosa, la teca y la formación del antro folicular, dando lugar a un Folículo Preovulatorio.
El folículo preovulatorio adquiere gran capacidad esteroidogénica produciendo altas concentraciones de Estradiol –E2-, sin embargo la capacidad para ovular solo se obtiene en las últimas horas del Desarrollo Folicular.
Al crecimiento folicular terminal sigue un patrón de “Onda De Crecimiento Folicular”. En los rumiantes las ondas foliculares se presentan antes de la pubertad, en la fase luteal del ciclo estral y durante la preñez.
En el bovino se han identificado de 2 a 4 ondas (PEÑA)
Una onda folicular implica el desarrollo sincrónico de un grupo de folículos individualmente identificables a partir de un diámetro de 4 mm que ocurre al mismo tiempo en ambos ovarios. Durante aproximadamente 2 a 3 días todos los folículos crecen hasta la formación de un Folículo Dominante –FD-, mientras que el resto de folículos, denominados Folículos Subordinados, se vuelven atrésicos y regresan.
Independientemente de la especie, y del número de oleadas, cada onda consta de tres períodos:
1. De Reclutamiento.
El reclutamiento folicular se refiere a la formación de una población de folículos antrales de donde uno o varios, dependiendo de la especie, es seleccionado para la ovulación . En cada ciclo ovárico es reclutado un grupo de folículos primordiales que crecen de manera continua debido a los incrementos en las concentraciones de FSH.Se considera que es un proceso continuo que se inicia poco después de la formación del
folículo, mucho antes de la pubertad.
Tan pronto como ocurre la formación del folículo, algunos de ellos dejan la reserva y empiezan a crecer. Este proceso se conoce como activación folicular. Cuando algún folículo sale de esta reserva, sigue creciendo hasta la ovulación o hasta que se degenera .
Una segunda fase es la de reclutamiento cíclico que se inicia luego de la pubertad y resulta del incremento en los niveles de la FSH en la circulación sanguínea durante cada ciclo ovárico en que se rescata a un grupo de folículos antrales de la atresia.
Antes de la formación del antro, el ovocito no es capaz de crecer más allá del diploteno de la primera división meiótica. Durante el reclutamiento cíclico, solamente sobrevive un número limitado de folículos y el destino del resto es la atresia. Los ovocitos en los folículos que sobreviven completan su crecimiento, adquieren su zona pelúcida y son competentes para reiniciar la meiosis.
El reclutamiento es detectado por ultrasonido como el crecimiento de un grupo de folículos de 4 mm que ocurre durante los primeros 5 días del ciclo estral. Después de la emergencia de una oleada 7 a 11 folículos entran en una fase de crecimiento común.
2. De Selección.-
La selección folicular ocurre al final de la fase común de crecimiento. El folículo dominante crece a una tasa constante y el resto de los folículos subordinados sufren atresia o temporalmente crecen a una velocidad menor y posteriormente dejan de hacerlo. A este fenómeno se le ha denominado desviación
La desviación durante la oleada folicular en bovinos empieza con una reducción en la
tasa de crecimiento de los folículos subordinados; en contraste, se presenta una tasa de
crecimiento constante en el folículo dominante.
En novillas la desviación de la tasa de crecimiento de los dos folículos de mayor diámetro tiene inicio cuando el diámetro del futuro folículo dominante y el del subordinado son de 8,5 y 7,7 mm, respectivamente, 2 a 3 días después de iniciada la oleada.
El intervalo desde que empieza la disminución de los niveles de FSH y el inicio de la desviación es de 3 días en la vaca y la yegua. Después de haber iniciado la desviación, las concentraciones de FSH siguen bajando durante 10 a 20 hs en novillas. Se ha señalado también que el folículo seleccionado suprime la secreción de FSH, dando como resultado final la regresión o atresia de los folículos subordinados.
Los factores intrafoliculares que han sido sugeridos como candidatos para la regulación de la desviación son aquellos relacionados con el sistema de los factores de crecimiento similares a la insulina (IGF), esteroides, inhibina-A, activina-A, receptores de gonadotropinas, factores angiogénicos y otros factores intrafoliculares.
Sin embargo, los únicos factores que han estado implicados funcionalmente en la desviación son los IGF y su sistema asociado, el estradiol y los receptores de la hormona luteinizante (LH). El mecanismo que activa esos procesos bioquímicos ocurre durante el descenso progresivo en las concentraciones circulantes de FSH y un incremento inicial de la LH.
Sin embargo, los únicos factores que han estado implicados funcionalmente en la desviación son los IGF y su sistema asociado, el estradiol y los receptores de la hormona luteinizante (LH). El mecanismo que activa esos procesos bioquímicos ocurre durante el descenso progresivo en las concentraciones circulantes de FSH y un incremento inicial de la LH.
3.- De Dominancia.
En esta fase, un folículo se desarrolla de forma rápida y a su vez impide el desarrollo de los folículos subordinados así como el reclutamiento de un nuevo grupo de estructuras foliculares.
La FSH llega a sus niveles más bajos alrededor del día 2 a 5 cuando el FD alcanza los 8,5 mm. En este momento, los niveles se encuentran por debajo de los niveles necesarios para el desarrollo de los folículos subordinados los que se atresian, mientras el folículo dominante adquiere la habilidad de seguir creciendo con los niveles bajos de FSH.
La disminución de la FSH es producida por la inhibina, secretada por todos los folículos en desarrollo y el 17β- estradiol producido especialmente por el folículo dominante.
La razón por la cual el FD puede crecer con bajos niveles de FSH mientras los subordinados entran en regresión puede estar relacionada con la síntesis de receptores para LH en las células de la granulosa del FD.
Todos los folículos poseen receptores de LH en las células de la teca y de FSH en las células de la granulosa, pero solo el FD adquiere receptores de LH en las células de la granulosa. La LH se une a los receptores de las células de la granulosa estimulando una mayor producción de estradiol que le permite al Folículo Dominante seguir creciendo aunque disminuyan los niveles de FSH circulante, por lo que se dice que el FD > de 8 mm es LH dependiente. La relación entre los niveles de LH y el crecimiento folicular también puede explicar el fenómeno de regresión del FD de las ondas foliculares anovulatorias y el comienzo de la siguiente onda folicular.
Los altos niveles circulantes de progesterona producidos por el CL, disminuyen la frecuencia de pulsos de LH y causan la suspensión de las funciones metabólicas del FD, por lo que cesa la producción de 17β estradiol e inhibina lo que sucede antes de la disminución del diámetro del FD, y tiene como consecuencia el aumento de las concentraciones de FSH que van a reclutar los folículos de la siguiente onda folicular.
Por el contrario, al presentarse la luteolisis al final del ciclo hay un incremento de los pulsos de LH que estimula el crecimiento del FD y una mayor producción de 17β- estradiol, que induce los síntomas de celo y el pico preovulatorio de LH. El pico de LH finalmente conduce a la ovulación o expulsión del oocito a la fimbria del tracto genital femenino para ser fecundado.
4.- De atresia.
La atresia es un proceso que involucra a los folículos que no entran en proceso de dominancia. De hecho el 90% de los folículos entran en un proceso degenerativo irreversible y se presenta en forma continua durante el ciclo estral. Se refiere a la regresión del antro folicular y la apoptosis de las células del folículo subordinado que acompaña los cambios degenerativos del folículo antral, los cuales no se expusieron a unas condiciones endocrinas adecuadas para continuar desarrollándose y entran en atresia dentro del ovario. Este proceso sucede durante cada onda folicular cuando los niveles de progesterona están altos, sin embargo estos folículos subordinados producen algo de estradiol.
La apoptosis es una forma de muerte celular, que está regulada genéticamente. Cuando una célula muere por apoptosis, empaqueta su contenido citoplasmático, lo que evita que se produzca la respuesta inflamatoria característica de la muerte accidental o necrosis. En lugar de hincharse o reventar y por lo tanto, derramar su contenido intracelular dañino enzimático hacia el espacio extracelular, las células en proceso de apoptosis y sus núcleos se encogen, y con frecuencia se fragmentan conformando vesículas pequeñas que contienen el material citoplasmático. De esta manera, pueden ser eficientemente englobadas vía fagocitosis y, consecuentemente, sus componentes son reutilizados por macrófagos o por células del tejido adyacente.
La primera onda de DF se detecta el día de la ovulación Dia 0. La segunda onda comienza en el día 9 – 10 para los ciclos de 2 ondas y 7 a 9 en los ciclos de 3 ondas. En los ciclos de 3 ondas la tercera onda emerge el día 15-16.
La duración del ciclo estral va a estar relacionada con la cantidad de ondas. Para el ciclo de 2 ondas es de 18 a 20 días y para el de 3 ondas es de 21 a 23 días. Si bien el 95% de los ciclos estrales es de 2 a 3 ondas, se ha encontrado ciclos de 4 ondas en Bos indicus aunque otros estudios han encontrado una preponderancia pareja. En caso de un ciclo de 4 ondas, esta comienza el día 20 o 21 y su duración será de 24 a 25 días (BO).
Estos patrones son valores promedio ya que existe gran variabilidad individual, especialmente en la segunda onda que puede comenzar entre los días 6- 12 en distintos animales. De otra parte, factores como el balance energético negativo, las altas producciones de leche, el estrés calórico y el medio ambiente pueden modificar el patrón del Desarrollo Folicular.
El Desarrollo no se afecta por la presencia ipsi o contralateral de un CL, a pesar que en el bovino un 70% de las ovulaciones ocurren en el ovario derecho.
El Cl comienza su regresión más temprano en los ciclos de 2 ondas (día 16) que en los de 3 ondas (Dia 19)
El FD controla el desarrollo de los subordinados a través de hormonas como estradiol, inhibina, folistatina y FCs actuando en forma local o sistémica. Se ha postulado igualmente que el DF es regulado a nivel de ovario por el proceso de angiogenesis por el Factor de Crecimiento Endotelio Vascular -VEGF-
. De igual manera la FSH actúa como una molécula antiapoptotica en el DF evitando la atresia.
OVULACION
La ovulación es un proceso complejo que se inicia con el pico de LH e involucra varios eventos bioquímicos que conducen a la expulsión del oocito y tienen como propósito final la destrucción del tejido folicular.
Uno de los principales eventos es la hiperemia local que se cree controla los niveles de histamina y PGE2. Se ha demostrado que el flujo sanguíneo en el ovario se incrementan 7 veces después de la administración de hCG. Este aumento de flujo en el folículo dominante induce el edema de la teca interna lo que aumenta la permeabilidad vascular estimulada por la histamina la PGE2 y PGF2α. Consecuentemente el FD produce Factores Angiogénicos lo que indica que el FD controla su propio flujo sanguíneo.
El efecto del aumento del flujo sanguíneo permite que el FD tenga los suficientes ingredientes hormonales y metabólicos para la maduración final.
Se ha establecido que el mecanismo que regula la DF está basado en respuestas diferenciales de los folículos a la FSH-LH. Se ha demostrado que hay incrementos en la concentración de FSH que comienzan 2 días antes de la emergencia de cada onda folicular. Otros trabajos demostraron que alrededor del momento del celo hay 2 picos de FSH. El primer pico ocurre al mismo tiempo que el pico preovulatorio de LH y es inducido por la liberación de GnRH desde el hipotálamo. El segundo tipo ocurre cerca del momento de la ovulación y es aparentemente el responsable del reclutamiento de los folículos de la primera onda folicular (BO).
Al mismo tiempo en que los perfiles de crecimiento del folículo dominante y de los subordinados comienzan a diferenciarse (momento de la desviación) la FSH desciende rápidamente, llegando a los niveles más bajos alrededor del día 2 -5 cuando el folículo dominante alcanza 8.5 mm. En este momento, los niveles de FSH se encuentran por debajo de los niveles necesarios para el desarrollo de los folículos subordinados que se atresian, mientras el FD adquiere la habilidad de seguir creciendo con bajos niveles de FSH. La disminución de FSH es producida por la inhibina, que es aparentemente secretada por los folículos en desarrollo, y el estradiol-17β que es producido principalmente por el FD.
La razón por la cual el FD puede crecer con bajos niveles de FSH mientras los subordinados se atresian puede estar relacionada con la síntesis de receptores para LH en las células de la granulosa del FD. Todos los folículos poseen receptores LH en las células de la teca y de FSH en la granulosa pero solo el FD adquiere receptores de LH en las células de la granulosa. Los receptores de LH aumenta abruptamente a partir del día 4 de la onda, cuando el FD tiene más de 8 mm de diámetro. La LH se unirá a los receptores de las células de la granulosa estimulando una mayor producción de estradiol que le permitiría al folículo seguir creciendo aunque disminuyan los niveles de FSH circulante. Por esta razón se dice que el FD > 8 mm es LH dependiente.
La relación entre los niveles de LH y el crecimiento folicular también puede explicar el fenómeno de regresión del FD de las ondas foliculares anovulatoias y el comienzo de la próxima onda folicular.
Los altos niveles de P4 producidos por el CL, disminuyen la frecuencia de pulsos de LH y causan la detención de las funciones metabolicas del FD. Este cese de la secreción de 17β estradiol e inhibina se produce una disminución del diámetro del FD, lo que tiene como consecuencia el aumento de las concentraciones de FSH que ha de reclutar los folículos de la siguiente onda folicular. Por el contrario al ocurrir la luteolisis hacia el fnal del ciclo hay un incremento de la frecuencia de los pulsos de LH que estimula el crecimiento del FD y una mayor producción de 17β estradiol, que inducen los signos de celo y el pico preovulatorio de LH.
Durante la gestación se presenta igualmente ondas foliculares pero las altas concentraciones de P4 hacen que el diámetro máximo del FD disminuya progresivamente hasta llegar a un diámetro de 8.5 mm en el noveno mes de gestación.
Luego del pico de LH las células de la teca producen progesterona -P4- en lugar de testosterona. Al principio esta transición solo involucra una poca cantidad de progesterona producida localmente. Esta elevación de la progesterona es esencial para la ovulación porque estimula la síntesis de colagenasa que origina la desintegración del colágeno, el mayor componente del tejido conectivo de la túnica albugínea, cubierta externa del ovario. Al mismo tiempo aumenta el líquido folicular dentro del FD evento que está estrechamente coordinado con la degradación enzimática de la túnica albugínea. A medida que avanzan estos dos procesos, el ápice del folículo o estigma es empujado hacia afuera. La ovulación en la vaca es espontánea.
La PGF2α ovárica estimula la contracción de la musculatura lisa del ovario de forma intermitente, incrementando la presión local forzando al estigma a protruirse de manera notoria en la superficie del ovario. De igual manera la PGF2α causa la ruptura de los lisosomas de las células de la granulosa, debilitando el ápice del folículo.
El papel desempeñado por la PGE2 es el de activar la conversión del plasminógeno en plasmina por medio del activador de plasminógeno (tPA o urokinasa). La plasmina interviene en la remodelación del tejido del ovario. El plasminógeno a su vez disuelve el coágulo del cuerpo hemorrágico y ayuda a la transformación del folículo en CL.
FORMACION DEL CL
Una vez se ha producido la ruptura del folículo y la ovulación se desarrolla la formación del CL, cuya principal función es la de secretar progesterona y efectuar los mecanismos tendientes a facilitar la implantación del embrión y mantener la gestación.
Cuando el folículo se rompe se produce la ruptura de los vasos dentro del folículo lo que induce la hemorragia y formación de un coágulo, estructura denominada Cuerpo Hemorrágico, el cual mantiene su apariencia entre el día 1 y 3 del ciclo. Del día 3 a 5 aumenta de tamaño y pierde su apariencia hemorrágica para dar lugar al denominado Cuerpo Amarillo, logrando su tamaño máximo a la mitad del ciclo coincidiendo con la mayor producción de progesterona, proceso que se ha llamado de luteinización.
Independientemente del grado de desarrollo o regresión estas estructuras se denominan comúnmente Cuerpo Lúteo.
Este cuerpo lúteo entra en regresión mediante el mecanismo denominado luteolisis, desapareciendo luego de cerca de 10 días después de la siguiente ovulación en forma del llamado Cuerpo Albicans.
La capacidad del CL para producir P4 depende del grado de vascularización de las capas celulares y la influencia de factores angiogénicos del tejido folicular.
Una producción o liberación deficiente de P4 conduce a fallas reproductivas o incapacidad para la implantación del embrión y mantenimiento de la gestación.
La luteolisis consiste en la regresión o degradación irreversible del CL. . En la vaca, este proceso es consecuencia de una interacción entre la secreción de oxitocina (OX) luteal y la PGF2a endometrial.
 Ocurre dentro de los tres últimos días de la fase lútea. Se caracteriza por una caída dramática de las concentraciones de P4. Si se efectúa una histerectomía total el CL se mantiene y se asemeja a un período gestacional.
Ocurre dentro de los tres últimos días de la fase lútea. Se caracteriza por una caída dramática de las concentraciones de P4. Si se efectúa una histerectomía total el CL se mantiene y se asemeja a un período gestacional.
El transporte de la PGF2α se lleva a cabo por medio de la vena utero-ovárica y los vasos linfáticos, los cuales están en estrecha unión con la arteria utero-ovárica y por efecto de contracorriente y difusión pasa al ovario.
Que estimula la producción de PGF2α?
Además de P4 las células luteales grandes sintetizan y secretan oxitocina en forma pulsatil, la cual es almacenada en gránulos semejantes a los observados en las terminaciones nerviosas del lóbulo posterior de la hipófisis. Durante la primera parte de la fase lútea la secreción de PGF2α es casi inexitente. La amplitud y frecuencia de los pulsos se incrementa al final de la fase lútea .
Además de P4 las células luteales grandes sintetizan y secretan oxitocina en forma pulsatil, la cual es almacenada en gránulos semejantes a los observados en las terminaciones nerviosas del lóbulo posterior de la hipófisis. Durante la primera parte de la fase lútea la secreción de PGF2α es casi inexitente. La amplitud y frecuencia de los pulsos se incrementa al final de la fase lútea .
Durante la luteolisis ocurren los siguientes fenómenos:
• Apoptosis.
• Invasión de macrófagos.
• Incremento en pico del factor de necrosis tumoral a.
• Disminución de la concentración de enzimas esteroidogénicas.
La PGF2α endometrial parece ser la que inicia la luteolisis en los rumiantes. Ha sido aislada del tejido endometrial y su máxima concentración se alcanza durante el período de regresión luteal
Recientemente se ha reportado la existencia de un péptido vasoconstrictor derivado de las células endoteliales del CL denominado Endotelin-1 (ET-1). Es un luteolítico local mediador/promotor de la regresión del CL, y un inhibidor de la secreción de P4. Se reporta además que el CL es el sitio de producción, acción y recepción del ET-1.
Los requisitos para que se presente la luteolisis son:
• Presencia de receptores de oxitocina en el endometrio
• Presencia de nivel crítico de oxitocina
• Síntesis de PGF2α por el endometrio.
La capacidad funcional del CL para producir progesterona depende del grado de vascularización de las capas celulares del folículo y la presencia de factores angiogénicos en el liquido folicular.
Los efectos luteolíticos de la PGF2α ocurren inicialmente mediante una disminución del flujo sanguíneo luteal. Esto podría estar directamente relacionado con las condiciones de hipoxia luteal creadas, lo cual es un estímulo para la liberación de ET-1 y la apoptosis de las células luteales.
 El momento en que comienza el periodo más crítico para iniciar la cascada de la luteolisis funcional ocurre entre las dos y tres primeras horas, después de la inyección de PGF2a. En este período, para producir un rápido incremento del ET-1, pueden ser tomadas múltiples vías.
El momento en que comienza el periodo más crítico para iniciar la cascada de la luteolisis funcional ocurre entre las dos y tres primeras horas, después de la inyección de PGF2a. En este período, para producir un rápido incremento del ET-1, pueden ser tomadas múltiples vías.
La PGF2α estimula la rápida liberación de oxitocina por las células luteales grandes (LLC). Esto podría también incrementar la liberación de ET-1 por las células endoteliales microvasculares de la superficie basal de las células luteales, lo que inicia un pico de liberación de ET-1 intraluteal, provocando la disminución de P4 de las células luteales (posiblemente las LLC) y al mismo tiempo produce una pronunciada vasoconstricción de las arteriolas. Como consecuencia se produce una severa depleción del flujo sanguíneo, luego de dos a tres horas de aplicada la inyección de PGF2a. Dicha depleción provoca una hipoxia luteal, que a su vez puede actuar como un mecanismo de retroalimentación positiva, incrementando aún más la liberación e ET-1
SINTOMAS DE ESTRO
Los síntomas de estro en la vaca son:
- Inquietud del animal
- Edematización de la vulva.
- Secreción vulvar cristalina.
- El animal monta otras vacas.
- El animal se mantiene quieto y se deja montar.
- Presencia de Folículo ovárico a la palpación.
- Utero túrgido enroscado a la palpación.
Los estrógenos incrementan el crecimiento vascular del endometrio, por lo que una vez que disminuye repentinamente su secreción después de la ovulación, provoca hemorragias petequiales en el endometrio (sangrado del metaestro) y presencia de sangre en la secreción vulvar mezclada con moco, dando una sensación de jugo de mora, sin mal olor, no siendo por lo tanto patologico.
La metrorragia es indicio que la vaca estuvo en celo dos días antes. Es frecuente observarla en novillas en los primeros estros.
La duración del ciclo en la vaca es de 18 a 21 días. La duración del celo es de 18 horas en Bos taurus. El celo que se inicia en la tarde se prolonga cerca de 2 a 4 horas más.
El Bos Indicus presenta una duración del celo más corta que el Bos Taurus, siendo igualmente menor la intensidad de los síntomas en el Bos Indicus (GALINA)
En las razas cebuinas tiene una duración de 5 – 7 horas, especialmente de noche.
Para el trópico Colombiano se reportan promedios en novillas cebú de 10 horas y en Holstein de 10 horas. (GONGORA)
De otra parte el comportamiento de monta exclusivo de las vacas cebú en estro es diferente a otras razas, siendo las vacas de mayor jerarquía las que realizan el mayor número de montas. El comportamiento de celo es menos intenso en las vacas cebú lactantes que las no lactantes o novillas. (THATCHER)
ACTIVIDAD OVARICA DURANTE EL CICLO ESTRAL VACA
MOMENTO DEL APAREAMIENTO
En los animales domésticos el apareamiento sólo ocurre durante el estro, que coincide con la ovulación. La duración del estro y la ovulación dependen de la especie y varía de una hembra a otra dentro de la misma. De igual manera varía por factores internos y externos. (HAFEZ)
En la vaca el momento óptimo para el servicio debe coincidir con el momento de la ovulación, por ello en ganado de leche o cruces con Bos taurus, los animales que entren en celo por la mañana se sirven en la tarde, si siguen en celo en la mañana siguiente se vuelven a inseminar o servir y las que entran en celo en la tarde, se sirven a la mañana siguiente.
En el caso de las razas cebuinas, por tener un período de celo más corto y su manifestación tan variable, se recomienda servir en el momento en que se observen los síntomas de celo.
Para tener un mayor control sobre la observación de animales con manifestaciones de celo y momento del servicio, se recomienda la revisión de los lotes de hembras para servir, en varios períodos del día, por parte de personal capacitado, en combinación con el empleo de hembras o machos receladores, así como marcadores en la cola, podómetros, circuitos de televisión.
Se recomienda igualmente mantener un sistema de registros adecuado con el fin de poder predecir la presentación del celo siguiente, teniendo en cuenta los resultados de la palpación rectal de rutina.
BIBLIOGRAFIA
ALMQUIST J.O. AMMAN R.P. Reproductive capacity of dairy bulls XI Puberal caracteristics and postpuberal changes
in production of semen and sexual activity of Holstein bulls eyaculated frecquently. J. Dariry Sci 59. 957
1.979
AMMAN R.P. SCHANBACHER B.D.- Physiology of male reproduction J. Animal. Sci 57 1.983
ARRAU J.- Cinética Folicular ovárica y su control. Curso Internacional Relaciones Materno Fetales y
Nuevas
Tecnologías En Transferencia De Embriones. Valdivia. 1.984.
BO G.A. DINAMICA FOLICULAR Y TRATAMIENTOS HORMONALES PARA SINCRONIZAR LA OVULACION
EN EL GANADO BOVINO. Memorias Congreso Venezolano de producción e Industria Animal. Valera
22 al 26 de Octubre. ULA. Trujillo 2002.
BOLIVAR J. TORO G.J. – Actividad ovárica postparto en yeguas criollas Colombianas. ACOVEZ
1989
D’ OCCHIO M.J, JILLELLA D. LINDSEY B.R. .- Factors that influence follicle Recruitment, growth and ovulation
during ovaria superstimulation in heifers: Opportunities to increanse
ovulation rate and embryo recocery
by delaying the exposure of follicles to LH. Theriogenology 51 : 9 – 35 . 1.999.
ESPINOSA VILLAVICENCIO- José Luis, y otros.CRECIMIENTO FOLICULAR OVÁRICO EN ANIMALES
DOMÉSTICOS: UNA REVISIÓN Ricardo Ortega Pérez, Alejandro Palacios Espinosa, Javier Valencia
Méndez y Carlos Fernando Aréchiga Flores
GONGORA A.- Fisiología del Estro y Factores que Afectan su Expresión en Bovinos a Nivel del Trópico. El Cebú
Asocebú N° 313 Marzo – Abril 2.000
GINTHER OJ. KNOPF L. KASTELIC JP. .- Temporal associations among ovarian events in cattle during oestrus cycles with two and three follicular waves. J. Reprod. Fertl 1.989 : 87 : 223 – 230.
HAFES ZE.S.E.- Reproducción e Inseminación Artificial en Animales. Editorial Interamericana. 1989.
HITTEL P. FAIR T. CALLESEN H and GREVE T. .- Oocyte Growth And Final Maturation In Cattle. Theriogenology
47 : 23- 32 . 1997
HOLY L.- Bases Biológicas de la Reproducción Bovina. Ed. Diana. 1983
MIHM M. GOOD TEM, IRELAND JLH. Decline in serum follicle stimulating hormone concentrations alters key
intrafollicular growth factors involved in selection of the dominant follicle in heifers. Biol. Reprod. 1.997 ;
57 : 1328 – 1337.
MORROW W.- VET. SCOPE. 14:. 1969 MORROW D. CURRENTE THERAPY IN THERIOGENOLOGY: Diagnosis,
treatment and prevention of reproductive diseases in animals. W.B. SAUNDERS COMPANY.
OLIVERA MARTHA-1,2, MV, Dr Sci Agr; Tatiana Ruiz1,2, MV, Ms, PhD; Ariel Tarazona1,2,Z,Ms; Carlos
Giraldo1,2,MV, Ms. El espermatozoide, desde la eyaculación hasta la fertilización. Rev Col Cienc Pec Vol.
19:4, 2006
PEÑA M. GONGORA A, ESTRADA J.- FACTORES DE CRECIMIENTO EN EL DESARROLLO FOLICULAR,
EMBRIONARIO TEMPRANO E IMPLANTACION. IMPLICACIONES EN LA PRODUCCION DE
EMBRIONES BOVINOS. Rev MVZ Cordoba 12 (1) 942-954 2007
EMBRIONES BOVINOS. Rev MVZ Cordoba 12 (1) 942-954 2007
RUIZ Z. – OLIVERA A. Ovarían follicular dynamics in suckled o zebu cows (Bos Indicus) by rea time ultrasonography.
Anim Reprod. Sci; 64:211-220.
SALVADOR ALEJANDRO, M.V., MSc. F.C.V.-U.C.V. Efectos del estrés calórico en vacas lecheras Fuente:
SAVIO JD. THATCHER WW. BADINGA L. DE LA SOTA RL. WOLFENSON D. Regulation of dominant follicle
turnover during the oestrous cycle in cows. J. reprod. Fertil. 1993 ;
97 : 197 – 203.
SAVIO JD. BOLAND MP. ROCHE JF. Development of dominant follicles and length of ovarian cycles in postpartum dairy cows . J. Reprod. Fert. 1.990 ; 60 : 51 – 89.
SCHROEDER H. .- Tratado de Obstetricia Veterinaria. 1.989
SENGER P.L. PATH WAY TO PREGNANCY AND PARTURITION Segunda Edición. Washington State Uniersity
Research & Technology Park 1610 NE Eastgate Blvd., Pullman, WA 99163-5607 Website:
www.currentconceptions.com E-mail:cci@pullman.com
SHILLE V. STABENFELDT H.- Clinical Reproductive Physiology In Dogs. Current Therapy In
Theriogenology:
Diagnosis, treatment and prevention of reproductive diseases in animals.
MORROW. Ed. W.S. SAUNDERS
COMPANY 1.980
SIROIS J. FORTUNE JE. Ovarian follicular dynamics during the estrous cycle in heifers monitored by real – time
ultrasonography. Biol. Reprod. 1.988 ; 39: 308 – 317.
SMITH LC. OLIVERA – ANGEL M. GROOME NP. ET AL .- Oocyte qualitu in small antral follicles in the presence
or absence of a large dominant follicle in cattle. J. REPROD. Fértil. 1996; 106: 193 – 199.
ZEMJANIS R.- Reproducción Animal Diagnostico y Técnicas Terapéuticas. Editorial Limusa. 1.981
VIVO.- www.vivo.colostate.edu/
WAGNER W. .- Principles of Hormone Therapy. Current Therapy In Theriogenology: Diagnosis, treatment and
prevention of reproductive diseases in animals. MORROW. Ed. W.S. SAUNDERS COMPANY 1.980
WOLFSDORF KE, DIAZ T, SCHMITT EJP. The dominant follicle exerts an interovarian inhibition on FSH - induced
follicular development. 48 : 435 - 447 Theriogenology . 1997























Para el miercoles cierto doc ?????
ResponderEliminarmuy bueno
ResponderEliminarADJUNTO EL LINK SOBRE TECNICAS DE REPRODUCCION ASISTIDA QUE ACTUALIZO PERIODICAMENTE. ESPERO SEA DE AYUDA DE CONSULTA. http://tecnicasreproduccionasistidabovinos.blogspot.com
EliminarSALUDOS RIVERA
ADJUNTO EL LINK SOBRE TECNICAS DE REPRODUCCION ASISTIDA QUE ACTUALIZO PERIODICAMENTE. ESPERO SEA DE AYUDA DE CONSULTA. http://tecnicasreproduccionasistidabovinos.blogspot.com
EliminarSALUDOS RIVERA
Buenisima la info
ResponderEliminarMuY interesante la infomaSión reproductiva
ResponderEliminarMUY IMPORTANTE E INTERESANTE LA INFORMACIÓN, HOY EN DÍA SE CUENTA CON MUCHA INFORMACIÓN RESPECTO AL TEMA ESTA MUY BIEN EXPLICADO Y DE FORMA MUY CLARA Y HABLAR DEL TEMA DE CICLO REPRODUCTIVO ES MUY IMPORTANTE EN LA REPRODUCCIÓN YA SEA PARA LECHE O CARNE Y TOMAR EN CUENTA EL COSTO BENEFICIO.
ResponderEliminarBuenos días, me centre en el tema sobre El desarrollo folicular con las 3 fases, de Reclutamiento, selección y dominancia. muy bien detallado este tema , muy interesante, muy claro sus explicaciones sobre este material publicado. realmente aprendí y rescate mucho conocimiento sobre este tema que estuve buscando. Gracias
ResponderEliminar